在过去十年间,电动汽车的高比能量电池技术发展一直是科学界一个重要的课题。传统锂离子电池经过几十年的发展创新不断,但仍因其储存电荷的物理化学限制而面临能量密度低等问题。金属空气电池提出了区别于传统锂离子电池电子插层的电化学反应方法,即转化反应也称作非插层反应,涉及了物相变化,如固-固、液-固或气-固转变。转化反应有独特的物理现象,包括新相的成核和生长、电极急剧的体积变化,和更为复杂的反应机制。可逆Li-O2电池(锂氧气电池)成为研究热点,然而随后的研究表明在有机环境中涉及氧气的氧化还原阻碍了完全的电化学可逆性的实现,充电电压和循环寿命问题远没有达到商业化应用的标准。


近日美国麻省理工学院Betar M. Gallant教授在Nature Reviews Chemistry上发表了关于碱性金属空气电池化学反应机理和应用的最新进展。综述重点介绍了针对锂氧气电池面临的电化学问题,对新兴的非水碱金属-空气电池领域的最新进展做了总结和展望。结合其他研究工作中对锂氧气电池的可取之处,做了三个方面的探讨。首先是对发生锂氧气电池氧化还原的环境的探索和认识,包括改变电解质或氧气电化学本身的性质。其次是寻找金属锂负极的替代金属,包括Na,K等碱性金属。第三条途径是通过探索新的反应气体重新认识正极的电化学反应,例如氧化或氟化气体。该篇综述回顾了前沿碱性金属空气电池的最新进展,并对其未来的可逆充电体系的发展做了进一步的展望。


(1) 金属-气体电池的原理
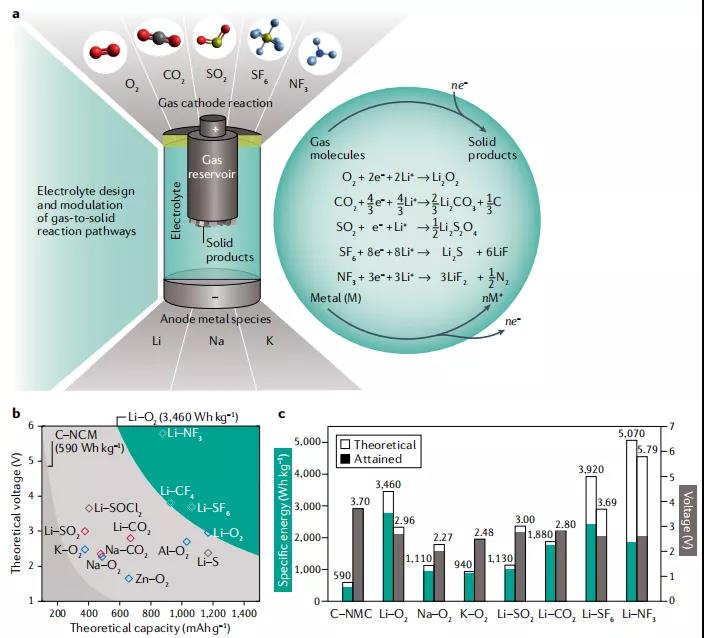
图1. 非水碱金属-气体电池的前景和电池性能。
作者以锂氧气电池为例,说明金属空气电池中气-固电化学反应的机理。即:
负极 : 2Li(s) ↔2Li + 2e-
正极 :O2(g) + 2e-+ 2Li↔ Li2O2(s)
电池反应 : O2(g) + 2Li(s) ↔ Li2O2(s)
该方程证明了金属空气电池有极高的比能量和高容量,因此尤其以锂氧气电池为代表的的金属空气电池体系得到了极大的关注。阴极反应发生在电极表面-如碳、金属、导电碳化物或氧化物电极上,这些表面也可以作为电催化剂来增强充放电动力学。放电时,固相在阴极表面及其孔结构内成核和生长,且产物的成核和生长方式一般对电解质和正极催化材料的性质以及充放电电流大小和过电位(实际电压与标准热力学电压E0的偏差程度)有着紧密的联系。合理设计并优化的电极结构能够可以保证充足的比表面和催化活性,以承载产物的生成和分解,从而达到优异的性能。
金属-氧气电池体系理想中最早是从空气中获得氧气作为反映气体的,然而它对水分非常敏感,因此目前普遍认为在实验条件下纯氧条件是必要的。鉴于反应活性和潜在的化学问题仍然普遍存在,碱金属-气体电池的发展没有实质性进展到原型阶段。
(2)Li-O2电池:电化学机制
早期锂氧气电池的研究使用了含有有机碳酸盐溶剂(如碳酸丙烯酯或碳酸乙烯酯/碳酸二甲酯)的电解质,但随后研究发现这些电解质容易在中间产物形成中降解。这种反应性导致碳酸锂的形成,使电池电化学不可逆。目前,非碳酸酯溶剂,如乙醚(甘氨酸和四氢呋喃(THF)或二甲基亚砜(DMSO)等被使用。因此电解质在锂氧气电池电化学反应方面起着重要的作用。
电解质对放电反应路径和可逆性的作用。在非碳酸盐溶剂中,O2被逐步还原,由于主要放电中间超氧化物的溶解度变化,该途径受到溶剂化学的强烈控制,可以分为表面和溶液成核两种机制。研究证明通过壳层分离、纳米粒子增强拉曼光谱和表面增强拉曼光谱证实了电极表面中O2−/LiO2中间体进行了反应, 溶液和表面通路之间的选择性是由Li与O2−反应决定的(图2a)。溶液生长使得Li2O2成核后在溶液中均匀生长,从而有利于大环形粒子生成(图2b),而不是如表面生长机制在电极表面观察到的薄膜状结构。促进产物的成核生长可以保存更多的电极活性位点,以便继续反应,从而增大放电容量,避免受电极表面钝化的限制。电解质的几种特性可以提高锂离子在溶液中的稳定性,从而促进溶液生长机制。如,有较高Gutmann donor number (DN) 的DMSO溶剂与锂离子有较强的结合能力,降低其Lewis酸度并倾向于在溶剂中结合O2−。基于此考虑,还可以使用放电氧化还原介质(RM)与还原氧中间体络合,并将它们通过电解质促进过氧化锂成核生长,如2,5-di(tert-butyl)-1,4-benzoquinone (DBBQ), combined DBBQ/H2O, PhOH, vitamin K2和coenzyme Q10等。除了电解质组成外,放电电流也影响电解质与氧根离子的浓度和过氧化锂的析出速率。通过改变放电电流,可以在一定条件下影响溶液(较低电流)或表面(较高电流)机制。然而,在放电过程中产生中间产物与许多电池组分反应,包括电解质,碳材料电极和聚合物粘结剂。在歧化过程中高活性单线态氧(1O2)形成被认为是大多数副产物产生的原因。因此,几乎所有的电解质在循环过程中都会积累一定的副产物产物(降低了电池的可逆性),包括碳酸锂和烷基碳酸盐等。虽然促进O2−溶解度能够有效提高容量,但它也加速了同一系统中的副反应,且其可逆性受到损害。副产物和过氧化锂本身的不导电性质导致了充电过电势的提高(图2c)。也有研究提出了解决电化学不可逆的问题,非碳电极的应用例如 Au、导电碳化物(如TiC)或氧化物等。相对于碳电极,有更大的氧化稳定性,耐腐蚀,形成副产物少。固体催化剂也能降低过电势,然而催化剂对促进过氧化锂分解的作用与其促进其他副反应的可能作用分离开来是很有挑战性的,因此很难明确地证明固体催化剂是否按预期发挥作用。可溶性RM,如LiI和LiBr,能够有效降低过电势 (~3.3-3.6V)。RM经历氧化(RM→RM+e−)以获得可溶性RM物种,如果它具有大于锂离子的2.96V的氧化还原电位,他就会则扩散到过氧化锂并将其氧化,从而再生成RM。然而使用RM的一个主要挑战是它们在大多数电解质中的高溶解度和扩散到阳极的能力,在阳极中RM可以氧化金属Li,而且RM也容易与1O2反应。总的来说,从重量、成本和电池水平的角度来看,非碳电极、固体和可溶性催化剂的实用性仍然不确定,而且在许多情况下将复杂的反应引入到了电池反应当中。

图2 电解质和氧源对非水锂氧电化学的影响。
即使正极反应问题能够得到解决,因生长较大的过氧化锂颗粒过程比较缓慢,要实现高容量放电也只能在低电流下实现。如果需要更大的电流,导致电极钝化和反应机理变化,因此导致可达到的电压和容量方面造成很大的损失。最后一个挑战是金属锂负极,可能存在于电解质的寄生反应,与氧气反应和锂枝晶问题,因而其本身可逆性问题尚未完全克服。
锂-‘氧’电池:超出传统的O2反应。上述挑战促使研究人员重新评估锂氧气电池中氧气氧化还原的基本性质。避免与过氧化锂分解产生高电压的一种选择是在放电时避免氧气向过氧化锂的完全反应。然而纳米材料在实际尺度上促进块状LiO2形成的能力仍不确定,而LiO2与常规电解质的化学反应活性仍是一个问题。第二种方法创造活性较低的电解质环境,使中间产物避免和有机电解液反应。熔融盐电解质(LiNO3-KNO3CSNO3)已被用于在150°C工作的锂氧气电池中,其容量大大提高。基于这一概念,人们可以将Ni作为硝酸熔盐中O2还原和演化的活性催化剂,以使O2在150°C下可逆还原为Li2O。事实证明,在熔融的硝酸盐电解质中,人们甚至不需要气态的O2作为氧化剂-电解质本身可以作为O原子的来源,电池可以在2.55V~的电压下充电。这项工作证明了使用散装电解质作为O原子可逆是可行的, 在NO3−/NO2−系统下的电化学反应避免了氧气参与,同时具有高度可逆性。然而,与所有熔盐系统一样,高温要求可能会限制其应用。第三种方法是将氧气的氧化还原完全限制在固相中。纳米锂(Li2O)-LiCoO2复合材料具有完全还原的O2−位点,可以氧化成Li2O2或者LiO2。使用有机碳酸盐溶剂混合物(碳酸乙烯酯-碳酸二乙酯)作为电解质使其可逆循环。虽然电压和循环得到提升,然而氧根离子与电解液之间的反应性导致阴极和阳极之间有机物种的穿梭现象,而且其可逆性的提高是以牺牲比能量和成本为代价的。
在实验室条件下,科研工作者已经对锂氧气电池中的氧化还原电化学反应做了非常大的贡献。然而,锂氧气电池进一步的发展在电池工作温度、化学可逆性、对贵金属的依赖和整体实用性方面提出了新的挑战。
(3)替代金属负极

图3. 碱金属负极在电池可逆性中的作用。
我们讨论的挑战主是正极的电化学,我们也同样可以通过替代金属负极来解决。与Li不同,Li不形成稳定的超氧化物,Na和K作为较大的碱阳离子(和较弱的路易斯酸)能形成稳定的超氧化物,因此提高了电化学可逆性。
Na-O2电池。2012年,Hartmann等人通过用Na替换电池中的Li,O2的氧化还原可逆性有了显著的改善。放电电压较低,在乙醚电解液(二甘醇二甲醚)中,电压仅~2.3V, 往返库仑效率~90%。虽然放电产物过氧化钠(Na2O2)在热力学上有利,但还原产物超氧化钠(NaO2)在实验观察中是放电产物主要相。Na系的比能量大大低于锂氧气电池体系(图1c),NaO2作为形成立方块,特征上比过氧化锂大得多(图3b)这也是溶液机制导致的, NaO2从过饱和电解质中化学沉淀形成大颗粒。与在O2/Li2O2中转移的2e−相比,O2/NaO2的单电子性质的促进了电化学反应。此外,碱金属超氧化物还存在在固相中,O-O键距离较短,有利于O2的简单演化,而且由于NaO2对有机碳酸电解质的反应性较低,避免了Na2CO3的形成。Na-O2放电产物的性质和稳定性仍然受到质疑。在之后研究表明,除了NaO2之外,还形成了如Na2O2, Na2O2·2H2O等产物。其他研究也得出结论,让电池处于静止状态对其可逆性具有很大损害。随着Na-O2电池的发展,几个相关的挑战接踵而至。其中最重要的是充电的不完全可逆性和有限的循环寿命。电池产物过度累积,堵塞了电极的孔隙,限制了氧气的传输和最终的比容量。正极和电解质之间的副反应仍然是一个问题,包括NaO2与电解液等。最后,对于Na负极,观察到枝晶的形成和与电解质盐的过度反应。因此 Na-O2的内在化学反应问题是否会在需要的范围内得到解决还有待观察和进一步研究。
表1.碱金属过氧化物、超氧化物和氧化物产物相的晶格结构数据
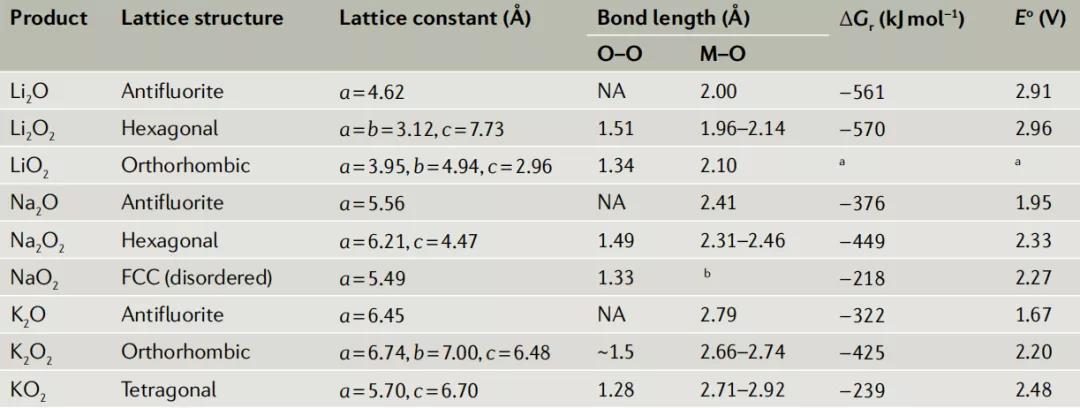
K-O2电池。 在2013年,钾氧(K-O2)电池被提出,超氧化钾(KO2,E0=2.48V对K+/0,Eq)在热力学和动力学上都比过氧化钾(K2O2,E0=2.20V对K+/0)和氧化钾(K2O,E0=1.67V对K+/0)更有利。这与实验一致,KO2被发现是主要的放电产物,但是其理论比能量仍较低(图1c),而放电电压略高于钠氧电池。其可逆性与Na-O2的可逆性大致相同,这使得该系统值得进一步研究(图3c)。与Li和Na相比,K的尺寸更大,使其有较弱的路易斯酸,有利于相应超氧物相KO2稳定。钾氧电池相对于锂氧和钠氧电池,其超氧化产物不易与电解液等反应,因而在多达30天循环后仍然有94%的库伦效率,而且生成的单线态氧比较少,稳定性更高。尽管其循环性能良好,但金属K负极的活性很高成为进一步开发该电池的主要障碍。钾与氧气的交叉和反应活性都很强,导致阳极钝化产生KO2、KOH、K2CO3和乙醚中的有机分解产物等。为了解决这一问题,一些策略侧重于保护阳极,例如使用K+导电SEI。这些成分将增加电池的重量,进一步降低其比能量密度。一种可能的策略是不用钾金属,最近一项研究中使用K[联苯]配合物作为负极,结合DMSO电解液和正极,在3000次循环后表现出>99%的库仑效率,然而这种稳定性的代价是与引入有机成分,其相对比能量和体积容量较低。总的来说,K-O2电池的性能指标需要继续改进,才能在商业上可行。
其他金属氧气电池。在探索替代负极金属作为可能的电极中,Ca和Mg等都做过相关的尝试。这些负极表现出较高得到稳定性,可逆性和电解质对碱金属的需求。这些替代系统不属于本综述的研究范围。

图 4. 改变气体阴极:对形貌和电化学的影响
(4)‘超出氧气’的气体正极
另一种解决Li-O2电池挑战的方法是彻底改变其化学反应,考虑新的气-固正极反应与Li负极耦合(图4)。改变正极反应气体避免过渡金属基氧化还原和使用Li阳极,这使得理论比能量很高。这种“超出氧气”正极因反应物不同大致分为两类。第一种是氧化物气体,可实现高循环性和高比能量(例如SO2),或者在特殊环境下发展新应用(例如CO2)。第二类是氟化物气体,在便携式应用中具有仍有超高的能量密度。
Li-SO2电池。Li-SO2最初是在1960年代开发的,由于其较长的循环寿命、良好的倍率性能和较宽的使用温度 (−40至55°C),其在军事和航空航天领域取得了应用。与Li-O2相比,Li-SO2系统的比容量较低,循环性能较差。但是最近研究表明通过替代反应途径(如涉及电解质盐参与的反应途径),提高了Li-SO2体系的循环能力。例如,LiAlCl4与SO2和C形成复合物,最终得到还原产物LiCl和LiClAl(OSO-C)3,从而实现了更好的可逆性(50个循环)。直到最近,Li-SO2电池使用SO2气体(而不是液体)以1M LiNTF2在四甘醇二甲醚(TEGDME)中作为电解质引入电池时才被证明具有很好的可逆性和循环寿命。Li2S2O4的可逆形成/分解可达到的放电电压略高于Li-O2,而充电电压显著降低(图4b)。产物Li2S2O4具有中心的S-S键,并由两个Li离子稳定的SO-二聚物,充电中电池表现出较低的迟滞现象,即使不使用固体催化剂,只有一个共价键断裂放出SO2气体的过程也容易实现。与Li-O2体系不同,O2−与电解液发生有害反应,SO2与有机碳酸盐溶剂的反应在热力学和动力学上是不利的,因此,使用有机碳酸盐溶剂可以提供更广宽的电化学稳定性窗口,较高的离子电导率,表现出更好的性能。通过使用可溶性RM,使用相对稳定的碳酸盐电解质,副产物的形成有所减缓,但Li2SO4的生成还是无法避免。此外SO2的毒性使其不能在EV应用中的广泛商业化。
Li-CO2电池。 另一个氧化物气体电池是Li-CO2,它可以从排放中CO2吸收气体参与电池反应。研究者已经提出了几种与总体反应一致的反应途径,由于很难在实验层面验证哪些途径是有效,所以反应争论仍然存在。在混合气体中首次研究了Li-O2/CO2电池的电化学反应,O2是活性反应物,它的还原速度快于CO2,而CO2会与生成的O2−反应。与锂氧气电池一样,溶剂决定了反应途径,DMSO等高DN溶剂优先产生Li2CO3,过氧碳酸盐阴离子(C2O62−)是该反应主要中间体。在甘氨酸等低DN溶剂中,Li2O2是主要产物,因为O2还原是表面进行和歧化的。无论如何,在这些混合气体系统中Li2CO3的形成是不可逆的,充电时没有释放O2。
不用混合气体而只研究以CO2作为独立气体反应物的电池首次在2013年报道。随后的研究表明,高容量,室温条件下的二氧化碳电池可以通过选择适当电解质实现。许多研究都对其复杂的逐步CO2还原过程进行了探索,但基本的反应过程仍需要研究。
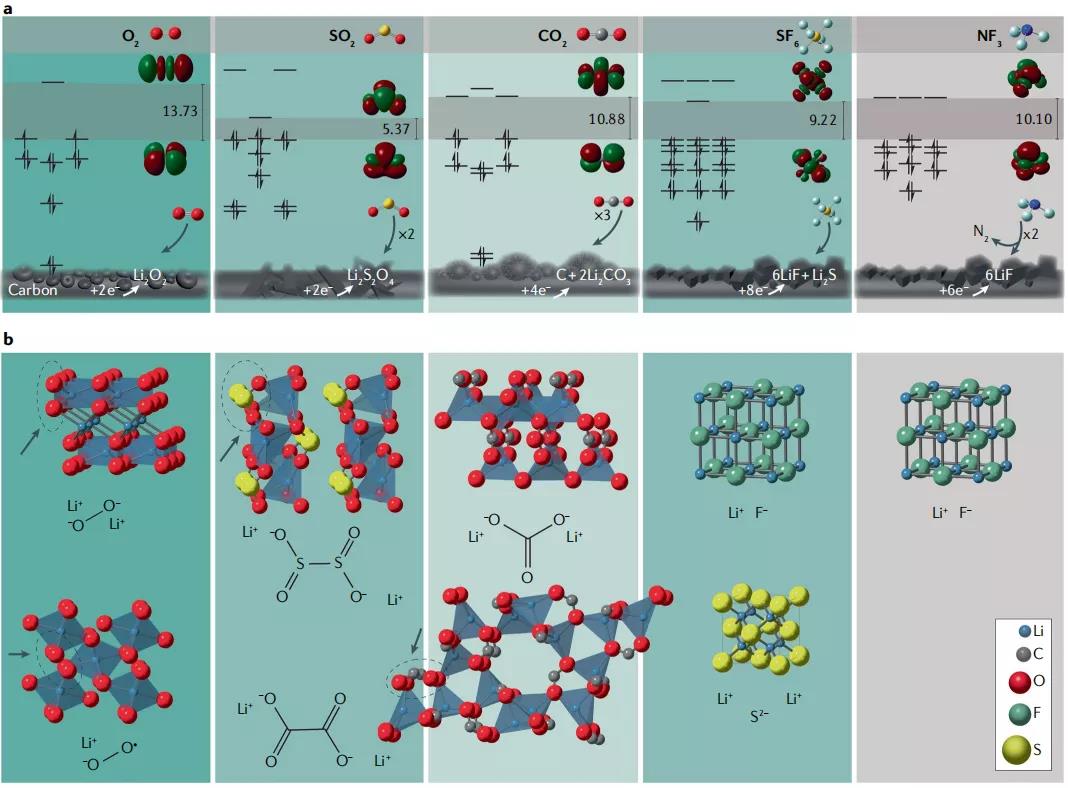
图5. 分子和固态可逆性的基本顺序。
锂二氧化碳电池系统的可逆性较差。虽然C和Li2CO3(图5a)都会在放电中生成,但是Li2CO3很难氧化分解,具有较大的电子带隙,因此需要较高的电压。在这些高电压下充电电池会加剧其降解,包括电解质分解和碳的腐蚀。大多数研究工作集中在确定所需反应途径的催化剂上。然而,其充电电压仍然太高,不适合实际使用,在高放电深度循环时,电化学可逆性的程度仍然不清楚。与Li-O2系统一样,实现这种系统可能需要对二氧化碳电化学环境进行重新设计。
Li-SF6电池。进一步增加比容量的一种方式是寻找能接受更多电子的气态反应物。理想情况下,新的反应物将比强氧化性气体O2和SO2更安全,包括在军事和空间运输和储存往往是不能实现的。其理论比能量甚至超过了Li-O2,SF6作为一种高度对称的氟化气体,被广泛认为是化学惰性的。因此,SF6是一种安全无毒的反应物,但其反应通常具有较高的活化能。在碳电极和TEGDME电解液中证明了SF6的在室温下的还原。然而,在正极和电解质中存在一些多硫化物产物表明,还形成了部分还原的产物,或可能与Li2S反应生成更复杂的产物。在TEGDME电解液中,Li-SF6可达放电电压为2.2V,大大低于理论值3.69V,通过将电解质改为DMSO等高DN溶剂,可以增加电压,室温下电压变化与氧化还原电位在TEGDME和DMSO之间的移动是一致的(图4c)。但是多个电子转移步骤上的高度复杂已经很难预测其还原反应步骤和机制。与Li-O2电池相似,Li-SF6电池中电解质的性质对固相成核有很大的影响,在这种情况下,LiF影响放电容量。使用低DN溶剂(如碳酸盐或乙醚)在放电开始时在正极上密集分布的LiF成核位,在完全放电后产生类似薄膜的LiF层。在高DN溶剂中,由于LiF溶解度的提高,成核中心稀疏,形成大的LiF颗粒。通过添加F−结合剂B(C6F5)3或稍微提高温度(从室温到50°C),都能增加F−溶解度,从而促进更大的LiF颗粒提高比容量。然而由于S-F键断裂的高度不可逆性,以及放电产物LiF和Li2S的高稳定性和电子电阻率,阻碍了充电中SF6的再生。这种金属-气体电池如果要应用到商业,仍然需要在提高电电压,倍率能力,能量密度方面进一步发展。
Li-NF3电池。该电池采用更低毒性的气体,但是比容量很高,主要得益于热力学稳定的N2和LiF产物的形成。在实验中,Li-NF3电池电压明显低于理论值,甚至略低于Li-SF6(图4c),然而即使在提高温度后,其比容量也远远小于达到理论值。与SF6一样,Li-NF3电池也是不可逆的。因此,释放其高比容量需要通过使用催化剂、探索其他电解质、较高的电池压力或操作温度来实现。SF6和NF3是温室气体,如果要提高性能,可以考虑其他多电子的反应气体。然而,要实现3-8e−分子反应并减少环境问题很困难,这些反应物利用了S、N、C和氧化物以外的其他非过渡金属分子所能获得的高氧化态。研究人员尝试开发的Li-N2电池(Li3N),尽管具有较低的理论电压(~1V),但是报道的电压高于理论电位,因此其氧化还原机制仍在研究中。
设计新的气体阴极:化学和性能。锂-空气电池不同的体系在可逆性和能量密度方面表现出广泛的性能。作者从考虑金属-气体系统的未来出发, 主要分了两个方面探索。第一种是真正可充电的金属-气体电池,其比能量密度超过锂离子电池。第二种是一种新的配方,其比能量超过了当今的技术水平。理想情况下,想要研究既能实现超高能量密度又能实现可逆性的系统需要确定的是这种系统是在理论上可能的,还是基本的物理和电化学限制阻碍了它们的发展。
与气体电极可逆性有关的一个因素是正极氧化剂的硬度,它决定了还原的程度,以及随着气体转化为固相而产生的电子重构。作者给出了绝对硬度与 HOMO-LUMO带之间的关系。基于硬-软(Lewis)酸碱理论,电子转移有利于氧化剂和还原剂之间的软-软相互作用,在这种相互作用中,氧化剂分子的电子结构重新配置,到可用的分子轨道中,而不发生剧烈的重组。这表明软气体分子将更有可能支持可逆还原,我们可以通过考虑到迄今为止描述的气态反应物的硬度来验证这一点(图5a)。总的来说,在比能量和可逆性之间存在着明显的权衡,因为多键的断裂使多电子转移反应成为可能,并且往往提供高度稳定的产物,然而,这些产物使反向反应复杂化。是否能满足在减少气体氧化剂的同时保持质量效率(气体的重量轻),形成足够稳定的固相,以达到高压,同时更容易充电,实现可控制电化学途径,以避免寄生反应达到长循环寿命,是有考察反应气体的重要指标。


综上所述,锂氧气电池的发展激发了科研工作者对相关能量体系的探索,然而这种性能尚未在一个真正可逆的电池中实现。进来的的研究解决了Li-O2的致命弱点-化学反应能力和较差的可逆性-真是对与氧正极电化学有关的新概念的丰富探索,以及对可充电电池进一步探索的的金属阳极类型的扩展。然而,每一种选择都有权衡,没有一种在性能指标上与锂氧气电池的最初的预期相匹配,也没有解决任何关于活性氧与有机介质不相容的问题。同时,通过降低比能量,虽然实现了可逆性,但是也引入新的、具有挑战性的正极负极副反应问题。考虑到金属-气体电池的严重可逆性问题,它们的发展集中在低倍率的表征上。但是对于电动汽车的应用来说,金属-气体电池的功率仍然太低。同时,化学反应问题导致其只有几十个或更少的循环,而锂离子电池可以循环多达数千次。目前有许多工程策略(电解质、RM、阴极和阳极设计)可用于改进其性能。最后,本文也提到采用其他气体反应和设计其他金属负极,但是最终都是要学习这些新的化学物质及其独特的氧化还原机制,以继续开展新的氧化剂研究,生产高倍率和比容量的的电池。


Haining Gao, Betar M. Gallant, (2020) Advances in the chemistry and applications of alkali-metal-gas batteries, Nature Review Chemistry, 10.1038/s41570-020-00224-7
https://www.nature.com/articles/s41570-020-00224-7
免责声明:以上内容转自深水科技咨询。文章仅代表作者个人观点,不代表新威研选立场。